Содержание
3 простые техники окрашивания волос в домашних условиях
Думаете, о том как красиво покрасить волосы дома? Тогда статья про простые техники цветного окрашивания волос в домашних условиях будет отличным решением, ведь цветное окрашивание сейчас это популярный тренд среди модниц любого возраста и один из самых простых способов преобразиться, сменив имидж. Некоторые обращаются к опытным мастерам-колористам (что является самым правильным, но достаточно затратным решением). Так как же поступить, когда душа просит перемен, но средств на окрашивание в салоне нет? – Тут нам на помощь приходят интернет-магазины, продающие красители, которые идеально подходят для использования в бытовых условиях, такие как Manic Panic, Arctic Fox, La Riche Directions, Anthocyanin и другие. Это удобно в том, что краски не нуждаются в окислители, не растекаются и смываются до изначальной базы за 3-4 недели.
И вот, когда краситель выбран, как же именно покраситься дома?
Мы выбрали три техники, которые без особых трудностей можно выполнить самостоятельно.
Однотонное окрашивание
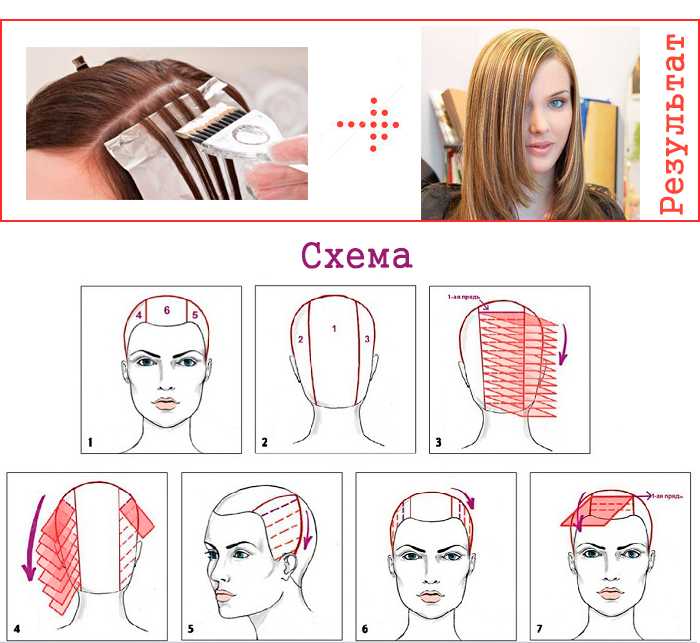
Самый простой способ — это окрашивание волос в один цвет или однотонное (монотонное) окрашивание. Его легко выполнить самостоятельно, но также присутствуют свои нюансы. Например: прокрасить волосы у лица (виски, челка) самостоятельно достаточно легко, но затылок и макушка более трудно прокрашиваемые зоны, которые требуют более внимательного прокрашивания, чтобы тон вышел ровным, без пятен.
Так же, если хотите покрасить волосы в более светлый тон, вначале необходимо смыть старую краску специальным средствами и только после этого, приступать к нанесению красителя.
Необходимо учитывать длину волос, если же волосы короткие, то красителя зачастую хватает с запасом, но на длинные волосы лучше приобретать пару упаковок краски, чтобы избежать неприятного конфуза, когда процедура окрашивания уже началась.
При окрашивании, краситель сначала наносится на затылочную и теменную зоны, т.к. виски окрашиваются гораздо быстрее.
Однотонное окрашивание волос
Омбре
Техника Омбре – это градиентный переход от одного цвета к другому. Чем плавне он выполнен, тем красивее смотрится прическа. Более сложная техника для домашнего окрашивания, но вполне выполнимая. Есть два типа омбре: классическое и обратное. В первом случае – это кончики волос, окрашенные в другой цвет, обратное омбре – это окрашенная макушка, а концы волос, наоборот, остаются естественного цвета.
Чем плавне он выполнен, тем красивее смотрится прическа. Более сложная техника для домашнего окрашивания, но вполне выполнимая. Есть два типа омбре: классическое и обратное. В первом случае – это кончики волос, окрашенные в другой цвет, обратное омбре – это окрашенная макушка, а концы волос, наоборот, остаются естественного цвета.
Для идеального выполнения этой техники, необходимо определить, где будет проходить линия перехода и осветлить волосы, будь это кончики или макушка.
Омбре из розовых красок для волос
Краткая инструкция, как сделать классическое омбре дома:
- Расчешите волосы, распределив их на отдельные пряди
- Там, где будет линия перехода, завяжите каждую прядь небольшой резиночкой для волос
- Нанесите осветлитель на волосы и подождите 35-40 минут
- Смойте с кончиков волос весь осветлитель и высушите волосы
- На осветленные сухие кончики, нанесите краситель и подождите 45+ минут
- Смойте с кончиков краску и наслаждайтесь результатом!
Мелирование
Классическая техника окрашивания волос, суть которой заключается в окрашивании или осветлении отдельных прядей. Мелирование не выходит из моды уже не один десяток лет.
Мелирование не выходит из моды уже не один десяток лет.
Дома мелирование проще всего сделать с помощью специальной шапочки для мелирования, которую легко можно приобрести без труда.
Мелирование волос
Небольшое руководство для мелирования дома поэтапно:
- Наденьте шапочку на голову, предварительно хорошо расчесав волосы
- Попросите кого-то или сами, с помощью кончика кисти для окрашивания, через отверстия в шапочке, достаньте пряди
- Нанесите осветляющую смесь на пряди на 30-45 минут
- Смойте осветлитель (НЕ СНИМАЯ ШАПОЧКУ)
- Высушите пряди
- Нанесите краситель и подождите 30-60 минут
- Смойте краситель, сняв шапочку
- Восхищайтесь своими волосами!
Каждая из вышеперечисленных техник хорошо и достаточно легко выполняется дома. Главное, пробуйте и экспериментируйте со своим образом, ведь в первую очередь, вы должны нравится самой себе. Приятного окрашивания!
Современные техники окрашивания волос.
 — aleks-school
— aleks-school
Окрашивание волос – один из беспроигрышных способов создания нового образа. Такое решение позволит выглядеть более свежо и стильно. Кроме того, данная процедура необходима тем, кто имеет невыразительный натуральный цвет волос или же просто хочет поэкспериментировать.
На данный момент используется ряд современных техник, которые позволяют минимизировать вред процедуры и сохранить здоровые волосы. В этом году есть несколько основных трендов окрашивания, которые помогут выглядеть стильно.
Стоит отметить, что сейчас в моде сочетание нескольких оттенков, а также создание их плавных переходов. Такие решения – интересная альтернатива классическому однотонному окрашиванию. Девушкам предлагается огромный выбор техник, с помощью которых можно с легкостью создать неповторимый образ.
Главное в этом вопросе – найти хорошего мастера, который не только поможет подобрать оптимальный вариант, но и выполнит процедуру максимально качественно.
Основные модные техники
В этом году особенно модным считается создание контраста за счет сочетания более светлых и более темных прядей. К основным техникам окрашивания можно отнести:
К основным техникам окрашивания можно отнести:
- Балаяж. Такой способ позволяет создать эффект выгоревших прядей – в результате получается очень естественная прическа. Для этого создаются переходы более светлых и темных оттенков. Тона подбираются в зависимости от цвета волос. При этом такие переходы не имеют заметной границы и отличаются плавностью.
- Скандинавский поинт. Данная техника является разновидностью блондирования и подразумевает создание плавного перехода холодных светлых оттенков на макушке к теплым на кончиках.
- Мелирование. Сама по себе эта техника давно вышла из моды и даже считается проявлением плохого вкуса. Однако современные способы мелирования подразумевают последующее тонирование, которое позволяет создавать стильные оттенки волос. В этом году особенно модными считаются пудровые, голубые цвета. При этом внешний вид получается более мягким и естественным.
- Омбре. Считается одним из наиболее модных трендов – в этом случае создается плавный переход темного цвета шевелюры к светлому или же наоборот.
 Такое решение одинаково хорошо подходит как блондинкам, так и брюнеткам. При окрашивании используется множество оттенков одного цвета, которые сочетаются по принципу градации.
Такое решение одинаково хорошо подходит как блондинкам, так и брюнеткам. При окрашивании используется множество оттенков одного цвета, которые сочетаются по принципу градации.
Помимо этого, можно выделить технику колорирования, которая также актуальна в этом сезоне. В данном случае используется хаотичное сочетание прядей различных оттенков. Причем цвет может быть как максимально естественным, так и ярким.
Эффекты современных техник окрашивания
Окрашивание – процедура, к которой прибегают не только для смены имиджа или создания нового образа. С его помощью также можно успешно скрыть ряд недостатков. Дело в том, что главной особенностью современных техник является тщательная прокраска каждой пряди, для которой выбирается собственный оттенок. По этой причине в результате получается цвет с множеством плавных переходов. Данную особенность можно использовать для создания таких эффектов:
- Увеличение объема. Использование переливов из различных оттенков поможет сделать волосы зрительно более густыми.
 Для выполнения такой задачи отлично подходит мраморное окрашивание, а также балаяж.
Для выполнения такой задачи отлично подходит мраморное окрашивание, а также балаяж. - Подчеркивание длины. Зрительно «вытянуть» прическу поможет скандинавский поинт или шатуш. Последняя техника подразумевает покраску с сохранением натурального цвета на макушке (как правило, выбирается более светлая палитра).
- Создание «эффекта укладки». Чтобы волосы выглядели более ухоженными, стоит выбрать технику с сочетанием несколько оттенков одного цвета. В данном случае хорошим решением станет колорирование.
Таким образом, выбор правильного варианта поможет сформировать продуманный образ, привлекающий взгляды!
Основные правила выбора техники
При выборе способа окрашивания стоит учитывать цвет глаз и кожи. Так, все техники блондирования не подходят кареглазым девушкам со светлой кожей. В таком случае оптимальным решением станет эффект омбре, балаяж или шатуш, в которых используются карамельные, шоколадные оттенки.
Обладательницам голубых глаз стоит использовать еще одну модную в этом сезоне технику – мелирование с созданием пепельного оттенка. Такое решение особенно смотрится особенно эффектно на коротких или волнистых шевелюрах. Отличным вариантом в этом случае станет любой из способов блондирования – от скандинавского поинта до хаотичного распределения более светлых и более темных прядей.
Такое решение особенно смотрится особенно эффектно на коротких или волнистых шевелюрах. Отличным вариантом в этом случае станет любой из способов блондирования – от скандинавского поинта до хаотичного распределения более светлых и более темных прядей.
3.4: Краткое изложение общих методов окрашивания бактерий
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15967
- Джоан Петерсен и Сьюзан Маклафлин
- Общественный колледж Квинсборо
Простой
Красители:
Кристаллический фиолетовый, метиленовый синий, сафранин
- Используется для окрашивания прозрачных бактериальных клеток
- Может использоваться для определения размера, морфологии и расположения клеток
Окраска по Граму
Первичная окраска – кристаллический фиолетовый
Морилка – йод; Decolorizer- 95% Ethanol
Контрастное окрашивание – Safranin
- Общий дифференциальный краситель
- Реакция Грама (положительная или отрицательная) отражает свойства клеточной стенки
- Также используется для определения размера, морфологии и расположения клеток
кислотный окрашивание
Первичное пятна-карбол Фуксин
Деколоризер-кислотный спирт
Contstain-метиленовый голубой
- Свтэйн, используемый для сцепления, сцепленной, ячейки, сцепляя с ячейкой, с Genecine Acdive Acdeciner Mysecine Acdecter Acidemine Mysecire Arictia Mysecine Acdecteria Acdecteria Acdecire Mylencine Acdecteria Acdecire Arictia MyTicenia.
 0083 Mycobacterium и Nocardia )
0083 Mycobacterium и Nocardia ) - Разработан для обнаружения видов бактерий, вызывающих туберкулез
- Кислотоустойчивые организмы устойчивы к обесцвечиванию кислотно-спиртовым раствором
Endospore Stain
Первичная окраска — малахитовый зеленый
Контрастная окраска — сафранин
- Эндоспоры устойчивы к окрашиванию основными красителями
- Эндоспоры окрашиваются малахитовым зеленым; вегетативные клетки окрашиваются сафранином
Окрашивание капсул (негативное окрашивание)
Используется кислотный краситель: (конго красный или нигрозин) и основной краситель: (кристаллический фиолетовый или сафранин)
- Негативные красители не фиксируются нагреванием и не промываются
- Фон предметного стекла окрашен кислотными красителями (капсула остается неокрашенной)
- Клетки внутри капсулы окрашиваются основными красителями
- Примеры инкапсулированных клеток: Bacillus anthracis , Streptococcus pneumoniae и Klebsiella pneumoniae
Окрашивание жгутиков
Нитрат серебра
- Используется для выявления жгутиков бактерий, которые слишком тонкие, чтобы их можно было увидеть с помощью других методов окрашивания
- Из-за нитрата серебра жгутики кажутся больше, чем они есть на самом деле
- Может использоваться для определения расположения жгутиков для идентификации.

- Пример: Proteus vulgaris имеет перитрихиальные жгутики
Окрашивание спирохет
Нитрат серебра
- Используется для визуализации тонких спирохет, таких как Treponema pallidum
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джоан Петерсен и Сьюзан Маклафлин
- Лицензия
- CC BY-NC-SA
- Показать оглавление
- нет
- Теги

Гистология, окрашивание — StatPearls — NCBI Bookshelf
Введение
Медицинская гистология — это микроскопическое исследование тканей и органов путем создания срезов, окрашивания и исследования этих срезов под микроскопом. Часто называемая микроскопической анатомией и гистохимией, гистология позволяет визуализировать структуру ткани и характерные изменения, которые могут произойти в ткани. Из-за этого он используется в медицинской диагностике, научных исследованиях, вскрытии и судебно-медицинском расследовании. После того, как образец ткани подвергся фиксации, обработке, заливке, разрезанию и окрашиванию, он может быть подвергнут анализу с помощью микроскопии, а результаты интерпретированы патологоанатомом. Выбор гистологических красителей для данного образца зависит от поставленного исследовательского вопроса. Усовершенствованная интерпретация гистологического препарата в сочетании с историей болезни пациента может оказать неоценимое влияние на ход лечения и прогноз.
Вопросы, вызывающие озабоченность
Базовые знания о подготовке тканей, включая окрашивание, важно знать при интерпретации отчетов о патологии как при стационарной, так и при амбулаторной биопсии. Не всегда интерпретирующий патологоанатом тщательно проанализировал образец ткани, включив соответствующее гистологическое окрашивание, и этот недостаток может замедлить постановку точного диагноза.
Структура
Четыре основных типа тканей человека можно окрашивать и просматривать с помощью различных гистологических методов. Эпителий, соединительная ткань, мышечная ткань и нервная ткань имеют общие черты, но после окрашивания выглядят очень различно структурно. Каждое пятно существует, чтобы выделить важную особенность или компонент в пределах типа ткани. Например, один из наиболее распространенных красителей, гематоксилин, представляет собой основной краситель, который окрашивает белки в синий цвет, а эозин окрашивает белки в розовый цвет. Эти два красителя обычно используются вместе для определения внутриклеточных органелл и белков. Из-за разнообразия существующих белков были созданы некоторые красители, чтобы выделить конкретный белок, который будет обсуждаться в следующих разделах этого обзора. Преимущество использования специального красителя заключается в том, что он очень хорошо выделяет конкретный белок. Однако из-за своей специфики другие структуры не будут видны. По этой причине из данного образца часто создается несколько слайдов, чтобы можно было выполнить несколько окрашиваний для сбора всего спектра необходимой информации.
Из-за разнообразия существующих белков были созданы некоторые красители, чтобы выделить конкретный белок, который будет обсуждаться в следующих разделах этого обзора. Преимущество использования специального красителя заключается в том, что он очень хорошо выделяет конкретный белок. Однако из-за своей специфики другие структуры не будут видны. По этой причине из данного образца часто создается несколько слайдов, чтобы можно было выполнить несколько окрашиваний для сбора всего спектра необходимой информации.
Функция
Почти все окрашивания тканей выполняются на тканях, которые были удалены с тела. Однако в редких случаях очень специализированные пятна, называемые жизненными пятнами, могут воздействовать на ткани, оставшиеся в организме. Эти пятна используются для идентификации определенных типов тканей и идентификации аномальной ткани, поэтому последующая биопсия может быть более точной при получении аномальной ткани.
Подготовка ткани
Прежде чем можно будет получить специфическое окрашивание, образцы ткани должны пройти следующие этапы подготовки: фиксация, обработка, встраивание, создание срезов и иногда поиск антигена. В современных гистологических лабораториях большинство этих этапов автоматизированы.
В современных гистологических лабораториях большинство этих этапов автоматизированы.
Фиксация: Фиксация использует химические вещества для сохранения структуры ткани в ее естественной форме и защищает ее от деградации за счет необратимо сшивающих белков. Хотя доступно несколько специализированных фиксаторов, нейтральный забуференный формалин является обычным выбором для этого этапа. Этап фиксации жизненно важен для остальной части процедуры гистологического окрашивания, потому что, сохраняя химический состав ткани, образец затвердевает и облегчает фазу срезов. Еще одним эффективным фиксатором является парафиноформалин. Его преимущество в том, что он является предпочтительным фиксатором для иммуноокрашивания; однако это требует подготовки во время фиксации. Буэн — это фиксатор, используемый для исследования эмбрионов и мозговой ткани из-за превосходной сохранности нежных ядер и гликогена. Его недостатком является то, что он плохо сохраняет ткани почек, а также искажает структуру митохондрий. [1]
[1]
Дегидратация: Добавление этанола завершает дегидратацию образца. Он удалил воду из образца и дополнительно затвердел ткань для возможной световой микроскопии. После применения этанола и после завершения обезвоживания ткани для удаления этанола используется ксилол.
Заливка: Заливка — это процесс помещения образца в парафиновый воск или пластиковую смолу для улучшения процесса извлечения клеточных структур. Этот шаг следует выполнять с осторожностью, если целью является иммуноокрашивание, поскольку парафиновый воск будет препятствовать проникновению антител и приведет к ложному результату.[1]
Срезирование: Срезирование включает в себя установку образца на микротом и его разрезание на срезы. Предпочтительная толщина составляет 4-5 микрометров, чтобы ее можно было окрасить и нанести на предметное стекло для исследования.[1]
Извлечение антигена: Этот этап предназначен для извлечения антигенов, которые могли быть охвачены на этапах фиксации и встраивания. Если перекрестное связывание белков скрывает участки антигена, иммуногистохимический ответ может быть не таким сильным. Извлечение антигена достигается с помощью нагревания и протеолитических методов для разрушения поперечных связей и выявления эпитопов и антигенов, которые ранее были покрыты. Хотя на этом этапе существует риск денатурации как фиксатора, так и самих антигенов, успешный метод извлечения антигена может привести к гораздо более эффективной интенсивности иммунного окрашивания.
Если перекрестное связывание белков скрывает участки антигена, иммуногистохимический ответ может быть не таким сильным. Извлечение антигена достигается с помощью нагревания и протеолитических методов для разрушения поперечных связей и выявления эпитопов и антигенов, которые ранее были покрыты. Хотя на этом этапе существует риск денатурации как фиксатора, так и самих антигенов, успешный метод извлечения антигена может привести к гораздо более эффективной интенсивности иммунного окрашивания.
Гистохимия и цитохимия
Гематоксилин и эозин
Как следует из названия, это два окрашивания, выполненные на последовательных этапах. Гематоксилин представляет собой основной краситель, окрашивающий кислые структуры. Полученный цвет имеет пурпурно-синий оттенок, а структуры, на которые нацелен этот краситель, называются базофильными. Базофильные структуры включают ДНК в ядрах клеток, РНК в рибосомах и шероховатый эндоплазматический ретикулум.[1]
Эозин – это контрастное окрашивание после гематоксилина, кислотный краситель, воздействующий на основные структуры. Полученный цвет имеет розово-красный оттенок, а структуры, привлекающие эозин, называются эозинофильными.[1] Цитоплазма является примером эозинофильной структуры.
Полученный цвет имеет розово-красный оттенок, а структуры, привлекающие эозин, называются эозинофильными.[1] Цитоплазма является примером эозинофильной структуры.
Краситель по Граму
Окрашивание по Граму — это метод последовательного окрашивания, разработанный для дифференциации видов бактерий. Его основная полезность заключается в определении возбудителя бактериальной инфекции путем окрашивания клеточной стенки.[2] Хотя не все бактерии имеют клеточную стенку и, следовательно, не могут быть окрашены этим методом, это все же очень полезное и часто выполняемое окрашивание. Бактериальный образец можно зафиксировать нагреванием и подвергнуть окрашиванию по Граму, выполнив следующие четыре этапа: первичное окрашивание кристаллическим фиолетовым, вторичное окрашивание грамм-йодом, обесцвечивание спиртом или ацетоном и контрастное окрашивание сафранином. Грамположительные бактерии содержат толстый слой пептидогликана, из-за чего они сохраняют фиолетовую окраску и кажутся фиолетовыми. С другой стороны, грамотрицательные бактерии имеют тонкий слой пептидогликана и больше липидов в клеточной стенке, поэтому этап обесцвечивания сильнее вымывает фиолетовый цвет, и образец выглядит розовым.[2]
С другой стороны, грамотрицательные бактерии имеют тонкий слой пептидогликана и больше липидов в клеточной стенке, поэтому этап обесцвечивания сильнее вымывает фиолетовый цвет, и образец выглядит розовым.[2]
Краситель Гимзы
Окрашивание по Гимзе широко используется в гематологии благодаря его превосходной способности окрашивать костный мозг, плазматические клетки и тучные клетки. Он также очень популярен для выявления паразитов крови.[3] Окрашивание по Гимзе также может помочь визуализировать хромосомные аномалии с помощью «полосатости по Гимзе» или наблюдения за чередованием более темных и светлых участков нуклеотидов на хромосомах во время митоза.
Периодическая кислотная реакция Шиффа
Окрашивание реакцией Шиффа с периодической кислотой, часто называемое окрашиванием PAS, представляет собой способ исследования структур, содержащих большое количество молекул углеводов, таких как щеточная кайма кишечника, клетки почечных канальцев, слизь и ретикулярные волокна соединительной ткани. [4] Гликоген, гликопротеин, гликолипиды и муцины окрашиваются в красный или пурпурный цвет, когда окрашивание завершено. Периодическая кислота, сильно окисленный йод, окисляет гидроксильные группы соседних молекул сахара с образованием альдегидов. После этого шага реагент Шиффа присоединяется к альдегиду и образует красно-пурпурный цвет для визуализации.
[4] Гликоген, гликопротеин, гликолипиды и муцины окрашиваются в красный или пурпурный цвет, когда окрашивание завершено. Периодическая кислота, сильно окисленный йод, окисляет гидроксильные группы соседних молекул сахара с образованием альдегидов. После этого шага реагент Шиффа присоединяется к альдегиду и образует красно-пурпурный цвет для визуализации.
Трихром Массона
Masson’s Trichrome Stain — это краситель, который может дать многоцветный результат на ткани. Несмотря на то, что он имеет красные контрастные пятна, он популярен благодаря своей способности окрашивать волокна коллагена в синий цвет. Трихром Массона может идентифицировать сердечный фиброз, легочный фиброз, хроническое заболевание почек и мышечную дистрофию.[7]
Красный Конго
Конго красный — водорастворимый синий краситель, образующий красный раствор при рН 3,0–5,0. Его многочисленные ароматические кольца могут складываться вместе посредством гидрофобных взаимодействий и накапливаться в тканях. В частности, конго красный может окрашивать амилоидные волокна в красный и оранжевый цвет, что делает его полезным для изучения при амилоидозе. При просмотре в поляризованном свете под микроскопом ткани с высоким содержанием амилоида, окрашенные конго-красным, будут иметь яркое двойное лучепреломление «яблочно-зеленого цвета». PMID: [8]
В частности, конго красный может окрашивать амилоидные волокна в красный и оранжевый цвет, что делает его полезным для изучения при амилоидозе. При просмотре в поляризованном свете под микроскопом ткани с высоким содержанием амилоида, окрашенные конго-красным, будут иметь яркое двойное лучепреломление «яблочно-зеленого цвета». PMID: [8]
Берлинская лазурь
Окрашивание берлинской лазурью полезно для определения запасов железа в организме.[7][9] Краситель работает, сначала окрашивая ткань соляной кислотой, а затем наблюдая, как ионы трехвалентного железа реагируют с образованием нерастворимого ярко-синего пигмента. Это полезно для диагностики состояний накопления железа, таких как гемохроматоз или гемосидероз, путем окрашивания ткани печени и наблюдения за накоплением железа вблизи перипортальных гепатоцитов или вдоль синусоидальной выстилки. Переизбыток запасов железа в костном мозге может сигнализировать о неэффективном эритропоэзе, например, при анемии хронического заболевания. С другой стороны, отсутствие реакции на окрашивание берлинской лазурью может указывать на низкий уровень железа, как при железодефицитной анемии.
С другой стороны, отсутствие реакции на окрашивание берлинской лазурью может указывать на низкий уровень железа, как при железодефицитной анемии.
Муцикармин
Муцикармин окрашивает муцин, секрет, вырабатываемый клетками эпителия и соединительной ткани.[12] Алюминий и кармин объединяются, образуя положительно заряженный хелатирующий комплекс. Новый положительный заряд связывает муцин, окрашивает его в красный цвет и позволяет визуализировать. Это полезно для выявления потенциальных карцином и воспалительных состояний, при которых наблюдается избыточная продукция муцина.[12] В хирургии окрашивание муцикармином также может определить первичную локализацию опухоли путем окрашивания секретирующего слизь эпителия в участке, не содержащем клеток, продуцирующих муцин.[13] Муцикармин также окрашивает студенистую капсулу грибов Криптококк .[12]
Черный Судан
Краситель Судан Черный окрашивает липидсодержащие структуры, такие как триглицериды и липопротеины, в темно-черный или коричневый цвет. быть окрашенным. Его можно использовать для диагностики атеросклероза путем окрашивания атеросклеротических бляшек и аутосомно-доминантной лейкодистрофии путем окрашивания макрофагов в белом веществе после посмертной биопсии головного мозга.
быть окрашенным. Его можно использовать для диагностики атеросклероза путем окрашивания атеросклеротических бляшек и аутосомно-доминантной лейкодистрофии путем окрашивания макрофагов в белом веществе после посмертной биопсии головного мозга.
Масляно-красный O
Подобно красителю суданскому черному, Oil Red O является наиболее распространенным красителем, используемым для гидрофобных жиров или липидов, веществ, которые традиционно трудно окрашивать. Oil Red O очень полезен для визуализации атеросклеротических бляшек и накопления липидов в печени и мышцах.[7][6][14]
Серебряное пятно
Окрашивание серебром — это более обширная категория окрашиваний, используемых для гистопатологического исследования заболеваний, связанных с накоплением, в неврологии. Существует несколько методов окрашивания серебром, в том числе по Бильшовскому, Галлиасу, Бодиану и Кэмпбеллу-Свитцеру. Выбранный метод окрашивания зависит от рассматриваемого неврологического поражения, поскольку каждый метод говорит о различной чувствительности и специфичности. Как правило, эти методы связывают ионы серебра или комплексы солей с тканью-мишенью. Затем они должны быть восстановлены на месте, а последующие частицы серебра накапливаются и могут быть проанализированы.[15] Недавно было использовано фторирование, когда флуорогенный полупроводник высвобождает небольшие наночастицы размером 6 нм в отложениях серебра и создает цвета. Диапазон диаметров образующихся частиц серебра соответствует разным цветам. Например, диапазоны от 10 до 20 нм дают желтый цвет, тогда как диаметры, превышающие 100 нм, дают черный цвет.[16]
Как правило, эти методы связывают ионы серебра или комплексы солей с тканью-мишенью. Затем они должны быть восстановлены на месте, а последующие частицы серебра накапливаются и могут быть проанализированы.[15] Недавно было использовано фторирование, когда флуорогенный полупроводник высвобождает небольшие наночастицы размером 6 нм в отложениях серебра и создает цвета. Диапазон диаметров образующихся частиц серебра соответствует разным цветам. Например, диапазоны от 10 до 20 нм дают желтый цвет, тогда как диаметры, превышающие 100 нм, дают черный цвет.[16]
Окрашивание серебром хорошо известно для обнаружения бета-амилоидного белка (Aß) при болезни Альцгеймера и телец Пика при болезни Пикса. При окрашивании амилоидные бляшки становятся темнее. Они могут варьироваться от желтого до черного, в зависимости от размера или количества амилоидных бляшек.[15]
Краситель Ниссля
Окрашивание по Нисслю, также называемое окрашиванием крезил-виолет, использует основной анилиновый краситель для изучения структуры нейронов в головном и спинном мозге. Нейропил окрашивается в голубовато-фиолетовые и зернистые пятна. Вещество Ниссля имеет большое количество рибосомной РНК, поэтому оно притягивает краситель, выглядит темно-синим и делает цитоплазму пятнистой. Преимущество использования окраски Ниссля для оценки патологии нейронов заключается в том, что она будет распознаваемо окрашивать цитоплазму нейронов, не окрашивая перикарионы других клеточных структур, таких как астроциты.[17]
Нейропил окрашивается в голубовато-фиолетовые и зернистые пятна. Вещество Ниссля имеет большое количество рибосомной РНК, поэтому оно притягивает краситель, выглядит темно-синим и делает цитоплазму пятнистой. Преимущество использования окраски Ниссля для оценки патологии нейронов заключается в том, что она будет распознаваемо окрашивать цитоплазму нейронов, не окрашивая перикарионы других клеточных структур, таких как астроциты.[17]
Пятно по Папаниколау
Окрашивание по Папаниколау, в просторечии называемое мазком Папаниколау, представляет собой метод цитологического окрашивания, наиболее известный для выявления рака шейки матки у пациенток. Клетки для окрашивания собирают из гинекологических мазков, образцов мокроты, соскобов, материалов для тонкоигольной аспирации и смывов. Мультихроматическое окрашивание включает пять красителей: гематоксилин для ядра, оранжевый G для кератина, эозин для поверхностных структур, светло-зеленый SF для цитоплазмы и бисмарк-коричневый [18]. В условиях скрининга рака шейки матки берут мазок Папаниколау, полученную окраску клеток эпителия переходной зоны шейки матки подвергают анализу на предраковые и раковые процессы. Часто готовят второй слайд для иммуноокрашивания биомаркером p16INK4a для выявления дисплазии [19].]
В условиях скрининга рака шейки матки берут мазок Папаниколау, полученную окраску клеток эпителия переходной зоны шейки матки подвергают анализу на предраковые и раковые процессы. Часто готовят второй слайд для иммуноокрашивания биомаркером p16INK4a для выявления дисплазии [19].]
Микроскопия световая
Световой микроскоп, также называемый оптическим микроскопом, можно использовать для просмотра живых или мертвых образцов. Увеличение ниже, чем у электронных микроскопов в 1500 раз. Метод освещения — это освещение микроскопа, а не пучок электронов.[20] Световой микроскоп используется для большинства пятен, описанных в этой статье, таких как окрашивание по Граму, H & E и окрашивание по Гимзе.
Электронная микроскопия
Электронный микроскоп полезен для просмотра внутриклеточных компонентов, невидимых при световой микроскопии, что помогает уточнить биологию аномальных тканей и клеток. Электронная микроскопия обычно дает увеличение в 100–300 раз больше, чем самое высокое увеличение световой микроскопии. [20] Как правило, срезы должны быть ультратонкими, чтобы обеспечить адекватное проникновение электронов. Наиболее полезными для электронной микроскопии являются гистологические красители с солями тяжелых металлов, поскольку они создают фазовый контраст, необходимый для визуализации структур.[21] Трансмиссионные электронные микроскопы лучше подходят для исследования внутриклеточных структур, в то время как сканирующие электронные микроскопы обычно лучше всего подходят для исследования поверхностных структур.
[20] Как правило, срезы должны быть ультратонкими, чтобы обеспечить адекватное проникновение электронов. Наиболее полезными для электронной микроскопии являются гистологические красители с солями тяжелых металлов, поскольку они создают фазовый контраст, необходимый для визуализации структур.[21] Трансмиссионные электронные микроскопы лучше подходят для исследования внутриклеточных структур, в то время как сканирующие электронные микроскопы обычно лучше всего подходят для исследования поверхностных структур.
Патофизиология
Использование специальных красителей для тканей не только помогает различить структурные изменения тканей, но также предупреждает врача об изменениях функции тканей, имеющих большое значение для постановки диагноза, таких как аномальное отложение железа или аномальное отложение белка [амилоидоз , парапротеинемия и т. д., аномальное накопление гликогена или других углеводов и аномальное накопление жира. Высокоспециализированное окрашивание может обнаружить многие другие изменения в клеточной физиологии.
Клиническое значение
Гистологическое окрашивание и исследование имеют очень большое клиническое значение в медицинской диагностике и лечении практически во всех областях медицины. Гистологическое исследование является золотым стандартом диагностики многих патологических заболеваний, для которых окраска является обязательным компонентом. Гистохимический анализ образца ткани позволяет патологоанатому не только поставить диагноз, но и определить тяжесть заболевания и дать прогноз.
Контрольные вопросы
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Алтуркистани Х.А., Ташканди Ф.М., Мохаммедсалех З.М. Гистологические пятна: обзор литературы и тематическое исследование. Глоб Дж. Науки о здоровье. 2015 25 июня; 8 (3): 72-9. [Бесплатная статья PMC: PMC4804027] [PubMed: 26493433]
- 2.
Brown RC, Hopps HC.
 Окрашивание бактерий в срезах тканей: надежный метод окрашивания по Граму. Ам Джей Клин Патол. 1973 августа; 60(2):234-40. [PubMed: 4124318]
Окрашивание бактерий в срезах тканей: надежный метод окрашивания по Граму. Ам Джей Клин Патол. 1973 августа; 60(2):234-40. [PubMed: 4124318]- 3.
Долан М. Роль окраски Гимзы в цитогенетике. Биотехнологический гистохим. 2011 апрель; 86 (2): 94-7. [PubMed: 21395494]
- 4.
Аль Дрис А., Салах Халил М., Солиман М. Гистологическая и иммуногистохимическая основа влияния аминогуанидина на почечные изменения, связанные с геморрагическим шоком на крысиной модели. Acta Histochem Cytochem. 2017 февраль 28;50(1):11-19. [Бесплатная статья PMC: PMC5374099] [PubMed: 28386146]
- 5.
Грин Дж., Луи Дж., Коростинска О., Мейсон А. Современные методы анализа гликогена скелетных мышц у спортсменов – необходимость новых неинвазивных методов. Биосенсоры (Базель). 23 февраля 2017 г. 7(1) [бесплатная статья PMC: PMC5371784] [PubMed: 28241495]
- 6.
Prats C, Gomez-Cabello A, Nordby P, Andersen JL, Helge JW, Dela F, Baba O , Ploug T.
 Оптимизированный гистохимический метод оценки запасов гликогена и липидов в скелетных мышцах выявил две метаболически различные популяции мышечных волокон I типа. ПЛОС Один. 2013;8(10):e77774. [Бесплатная статья PMC: PMC3813758] [PubMed: 24204959]
Оптимизированный гистохимический метод оценки запасов гликогена и липидов в скелетных мышцах выявил две метаболически различные популяции мышечных волокон I типа. ПЛОС Один. 2013;8(10):e77774. [Бесплатная статья PMC: PMC3813758] [PubMed: 24204959]- 7.
Вютей Т., Эррера Г., Додеро В.И. Красители и красители: от молекулярной структуры до гистологического применения. Front Biosci (Landmark Ed). 2014 01 января; 19 (1): 91-112. [PubMed: 24389174]
- 8.
Якупова Е.И., Бобылева Л.Г., Вихлянцев ИМ, Бобылев АГ. Конго красный и амилоиды: история и взаимосвязь. Отчет Biosci, 31 января 2019 г., 39(1) [бесплатная статья PMC: PMC6331669] [PubMed: 30567726]
- 9.
McGavin MD. Факторы, влияющие на видимость ткани-мишени на гистологических срезах. Вет Патол. 2014 янв;51(1):9-27. [PubMed: 24395975]
- 10.
Пармли Р.Т., Гилберт К.С., Уайт Д.А., Бартон Дж.К. Ультраструктурное усиление серебром реактивного железа с берлинской лазурью в гемопоэтических и кишечных клетках.
 J Гистохим Цитохим. 1988 г., апрель; 36 (4): 433–40. [PubMed: 2450121]
J Гистохим Цитохим. 1988 г., апрель; 36 (4): 433–40. [PubMed: 2450121]- 11.
Кларк П., Бриттон Л.Дж., Пауэлл Л.В. Диагностика и лечение наследственного гемохроматоза. Clin Biochem Rev. 2010 Feb;31(1):3-8. [Бесплатная статья PMC: PMC2826266] [PubMed: 20179792]
- 12.
Дапсон РВ. История, химия и способы действия кармина и родственных красителей. Биотехнологический гистохим. 2007 г., август; 82 (4–5): 173–87. [PubMed: 18074265]
- 13.
Куфе Д.В. Муцины при раке: функция, прогноз и терапия. Нат Рев Рак. 2009 г., декабрь 9(12):874-85. [Статья бесплатно PMC: PMC2951677] [PubMed: 19935676]
- 14.
Mehlem A, Hagberg CE, Muhl L, Eriksson U, Falkevall A. Визуализация нейтральных липидов с помощью масляного красного O для анализа метаболического статуса в организме и болезни. Нат Проток. 2013 Июн;8(6):1149-54. [PubMed: 23702831]
- 15.
Учихара Т. Серебряный диагноз в невропатологии: принципы, практика и пересмотренная интерпретация.
 Акта Нейропатол. 2007 май; 113(5):483-99. [Бесплатная статья PMC: PMC1868652] [PubMed: 17401570]
Акта Нейропатол. 2007 май; 113(5):483-99. [Бесплатная статья PMC: PMC1868652] [PubMed: 17401570]- 16.
Бруше М., Моронн М., Джин П., Вайс С., Аливисатос А.П. Полупроводниковые нанокристаллы как флуоресцентные биологические метки. Наука. 1998 г., 25 сентября; 281(5385):2013-6. [PubMed: 9748157]
- 17.
Кадар А., Виттманн Г., Липозитс З., Фекете С. Усовершенствованный метод сочетания иммуноцитохимии и окрашивания по Нисслю. J Neurosci Методы. 2009 30 октября; 184 (1): 115-8. [Бесплатная статья PMC: PMC2753838] [PubMed: 19615409]
- 18.
Chantziantoniou N, Donnelly AD, Mukherjee M, Boon ME, Austin RM. Зарождение и развитие метода окраски по Папаниколау. Акта Цитол. 2017;61(4-5):266-280. [PubMed: 28384641]
- 19.
Trunk MJ, Dallenbach-Hellweg G, Ridder R, Petry KU, Ikenberg H, Schneider V, von Knebel Doeberitz M. Морфологические характеристики p16INK4a-положительных клеток в образцах цитологии шейки матки.

 Такое решение одинаково хорошо подходит как блондинкам, так и брюнеткам. При окрашивании используется множество оттенков одного цвета, которые сочетаются по принципу градации.
Такое решение одинаково хорошо подходит как блондинкам, так и брюнеткам. При окрашивании используется множество оттенков одного цвета, которые сочетаются по принципу градации. Для выполнения такой задачи отлично подходит мраморное окрашивание, а также балаяж.
Для выполнения такой задачи отлично подходит мраморное окрашивание, а также балаяж. 0083 Mycobacterium и Nocardia )
0083 Mycobacterium и Nocardia )

 Окрашивание бактерий в срезах тканей: надежный метод окрашивания по Граму. Ам Джей Клин Патол. 1973 августа; 60(2):234-40. [PubMed: 4124318]
Окрашивание бактерий в срезах тканей: надежный метод окрашивания по Граму. Ам Джей Клин Патол. 1973 августа; 60(2):234-40. [PubMed: 4124318] Оптимизированный гистохимический метод оценки запасов гликогена и липидов в скелетных мышцах выявил две метаболически различные популяции мышечных волокон I типа. ПЛОС Один. 2013;8(10):e77774. [Бесплатная статья PMC: PMC3813758] [PubMed: 24204959]
Оптимизированный гистохимический метод оценки запасов гликогена и липидов в скелетных мышцах выявил две метаболически различные популяции мышечных волокон I типа. ПЛОС Один. 2013;8(10):e77774. [Бесплатная статья PMC: PMC3813758] [PubMed: 24204959] J Гистохим Цитохим. 1988 г., апрель; 36 (4): 433–40. [PubMed: 2450121]
J Гистохим Цитохим. 1988 г., апрель; 36 (4): 433–40. [PubMed: 2450121] Акта Нейропатол. 2007 май; 113(5):483-99. [Бесплатная статья PMC: PMC1868652] [PubMed: 17401570]
Акта Нейропатол. 2007 май; 113(5):483-99. [Бесплатная статья PMC: PMC1868652] [PubMed: 17401570]